澳科大學者發表「智能」分子網絡研究新成果
成功「點亮」活細胞內的疾病訊號
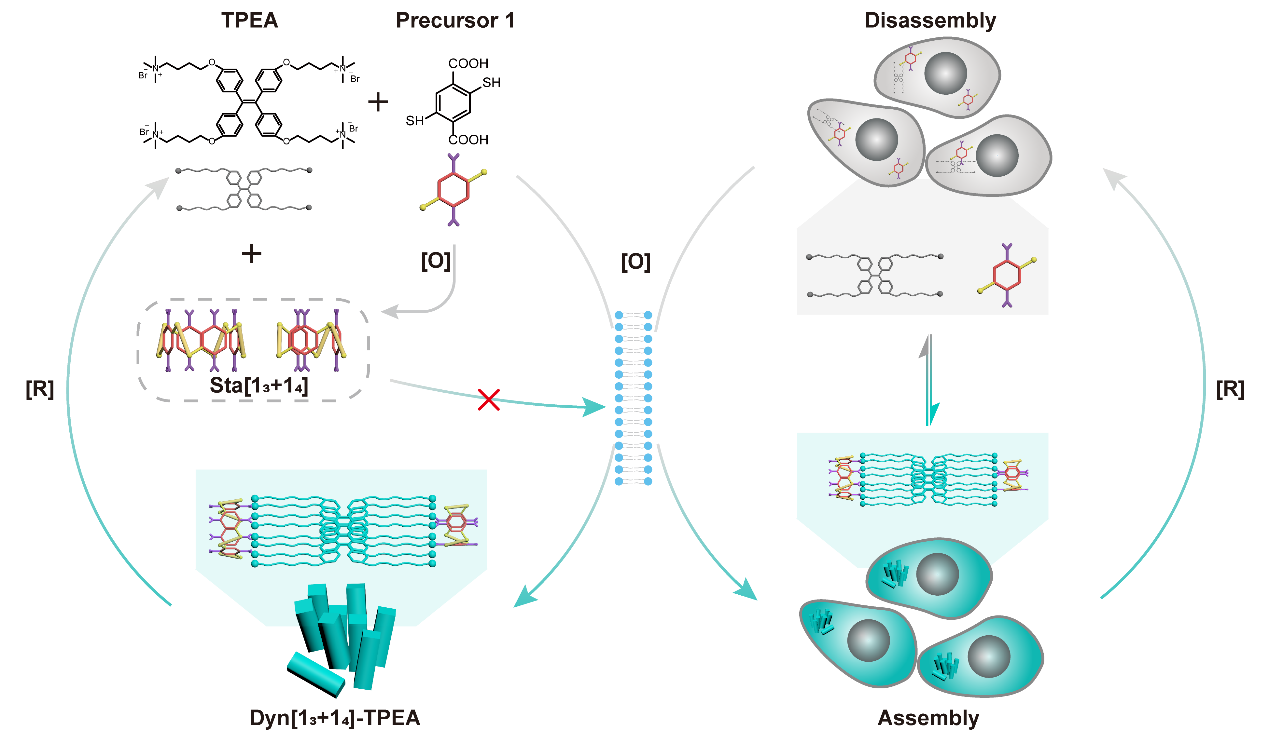
[圖一:該研究提出的「智能」分子網絡工作機制示意圖 1。在氧化應激(疾病信號)下,分子前體(Precursor 1)與熒光素(TPEA)在細胞內自動組裝,並發出熒光 。]
澳門科技大學創新工程學院─材料科學與工程研究院(MIMSE)李健維副教授領導的團隊,近日在「系統化學」(Systems Chemistry)領域取得重大突破,成功構建了一種能夠在活細胞內部自主響應疾病信號的「智能」合成分子網絡。
準確「讀取」活細胞內的氧化應激水平,是理解癌症、神經退行性疾病等重大疾病的關鍵 。然而,傳統檢測手段多為侵入性,必須將細胞裂解(即殺死細胞),這使得科學家無法實時捕捉疾病發展的動態過程。
「智能探針」的自組裝機制
研究團隊設計了一個由「建材」(分子前體1)和「訊號燈」(TPEA分子)組成的「智能」系統。這個系統利用疾病訊號(氧化應激)作為「觸發器」和「指令」。在氧化應激下,這兩部分「原料」會自動在細胞內部「原位自組裝」,形成發光的纳米结構,從而「點亮」疾病訊號。研究證實,這種由訊號觸發的「漸進組裝」過程是系統穩定運行的關鍵,避免了不受控制的聚集和沉澱。
可逆的「實時監控」與細胞驗證
該系統的最大突破在於其「可逆性」,使其成為一個可連續工作的「監視器」。研究發現,這個組裝過程是完全可逆的:加入還原劑(DTT)如同按下「關燈」開關,能使網絡解體,熒光「顯著淬滅」。而隨後加入氧化劑過氧化氫則如同按下「開燈」開關,能讓網絡「重新組裝」並「恢復」熒光。該系統在多達「六個周期」的循環中保持了「出色的穩健性和穩定性」。
團隊在活細胞實驗中驗證了這一點。在高氧化應激的MCF-7S乳腺癌細胞中,系統被成功激活,「點亮」了熒光訊號;相反,在ROS水平低的HDF健康細胞中,系統則保持「靜默」,沒有發出熒光。實驗更成功在活的癌細胞內實時演示了「開燈」和「關燈」的可逆循環。這一系列成果證實,該系統能作為動態的「實時監視器」,精準區分癌細胞與健康細胞。
關於該出版物和研究團隊
上述研究成果以「氧化驅動的合成分子網絡實現活細胞內的動態組裝和熒光調控」(Oxidation-driven synthetic molecular networks enable dynamic assembly and fluorescence modulation in living cells)為題,發表於國際頂尖期刊《細胞•報告•物理科學》(Cell Reports Physical Science)。該期刊是「細胞」(Cell)出版社旗下專注於物理科學與生命科學交叉領域的高影響力刊物。
澳科大材料科學與工程研究院李健維副教授為該論文的獨立通訊作者,來自於芬蘭圖爾庫大學(University of Turku)的訪問博士研究生楊敬輝為論文的第一作者。該研究也得到了来自圖爾庫大學的Anastassios C. Papageorgiou博士和Ermei Mäkilä博士的支持。
該研究得到了國家自然科學基金(22161016)、澳科大和芬蘭Sigrid Jusélius基金會等的財政支持。




























