澳科大学者发表「智能」分子网络研究新成果
成功「点亮」活细胞内的疾病讯号
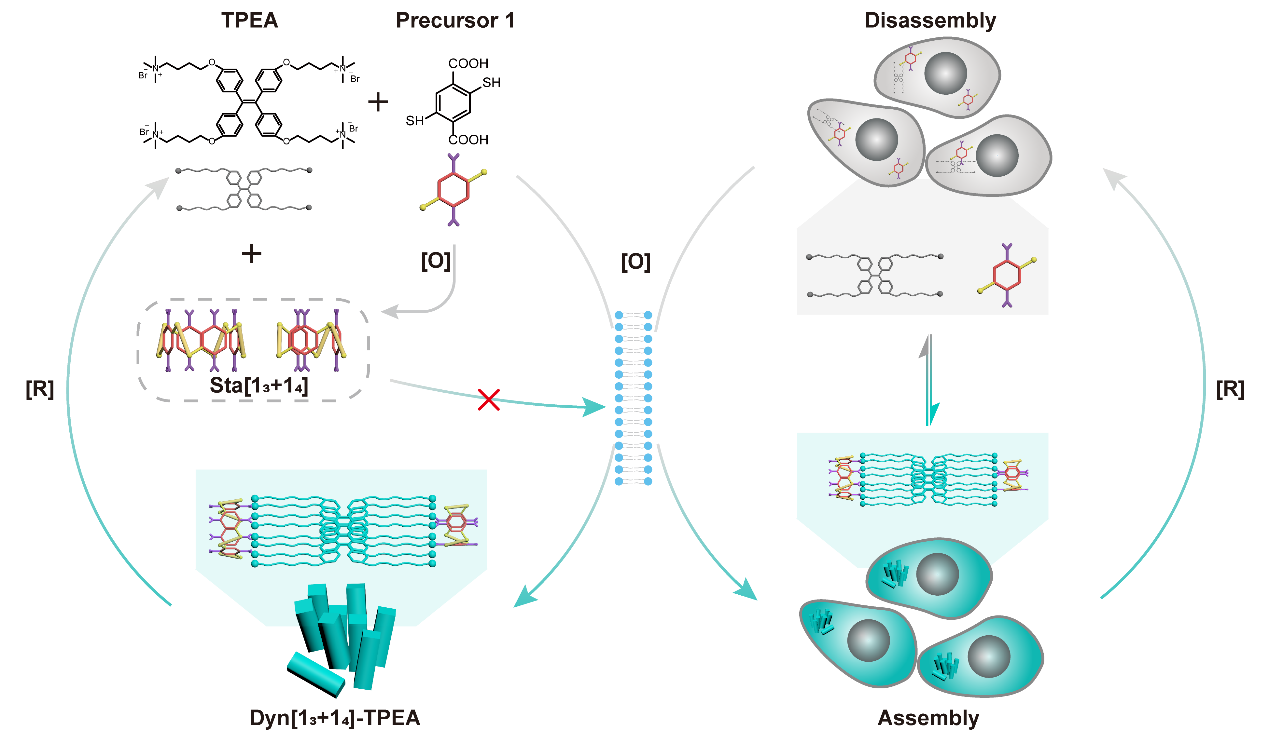
[图一:该研究提出的「智能」分子网络工作机制示意图 1。在氧化应激(疾病信号)下,分子前体(Precursor 1)与荧光素(TPEA)在细胞内自动组装,并发出荧光 。]
澳门科技大学创新工程学院─材料科学与工程研究院(MIMSE)李健维副教授领导的团队,近日在「系统化学」(Systems Chemistry)领域取得重大突破,成功构建了一种能够在活细胞内部自主响应疾病信号的「智能」合成分子网络。
准确「读取」活细胞内的氧化应激水平,是理解癌症、神经退行性疾病等重大疾病的关键 。然而,传统检测手段多为侵入性,必须将细胞裂解(即杀死细胞),这使得科学家无法实时捕捉疾病发展的动态过程。
「智能探针」的自组装机制
研究团队设计了一个由「建材」(分子前体1)和「讯号灯」(TPEA分子)组成的「智能」系统。这个系统利用疾病讯号(氧化应激)作为「触发器」和「指令」。在氧化应激下,这两部分「原料」会自动在细胞内部「原位自组装」,形成发光的纳米结构,从而「点亮」疾病讯号。研究证实,这种由讯号触发的「渐进组装」过程是系统稳定运行的关键,避免了不受控制的聚集和沉淀。
可逆的「实时监控」与细胞验证
该系统的最大突破在于其「可逆性」,使其成为一个可连续工作的「监视器」。研究发现,这个组装过程是完全可逆的:加入还原剂(DTT)如同按下「关灯」开关,能使网络解体,荧光「显著淬灭」。而随后加入氧化剂过氧化氢则如同按下「开灯」开关,能让网络「重新组装」并「恢复」荧光。该系统在多达「六个周期」的循环中保持了「出色的稳健性和稳定性」。
团队在活细胞实验中验证了这一点。在高氧化应激的MCF-7S乳腺癌细胞中,系统被成功激活,「点亮」了荧光讯号;相反,在ROS水平低的HDF健康细胞中,系统则保持「静默」,没有发出荧光。实验更成功在活的癌细胞内实时演示了「开灯」和「关灯」的可逆循环。这一系列成果证实,该系统能作为动态的「实时监视器」,精准区分癌细胞与健康细胞。
关于该出版物和研究团队
上述研究成果以「氧化驱动的合成分子网络实现活细胞内的动态组装和荧光调控」(Oxidation-driven synthetic molecular networks enable dynamic assembly and fluorescence modulation in living cells)为题,发表于国际顶尖期刊《细胞•报告•物理科学》(Cell Reports Physical Science)。该期刊是「细胞」(Cell)出版社旗下专注于物理科学与生命科学交叉领域的高影响力刊物。
澳科大材料科学与工程研究院李健维副教授为该论文的独立通讯作者,来自于芬兰图尔库大学(University of Turku)的访问博士研究生杨敬辉为论文的第一作者。该研究也得到了来自图尔库大学的Anastassios C. Papageorgiou博士和Ermei Mäkilä博士的支持。
该研究得到了国家自然科学基金(22161016)、澳科大和芬兰Sigrid Jusélius基金会等的财政支持。




























