全球成千上万人在与类风湿性关节炎(RA)[1]这个慢性自身免疫性疾病苦战,而这场对抗顽疾的战斗正在多个方面进行。澳门科技大学黄锦伟教授团队对RA展开深入研究,从揭开错综复杂的信号通路[2]、分子和细胞机制,再到探索创新的治疗策略,这些研究成果为改善患者的治疗效果和生活质量提供新的契机与曙光。
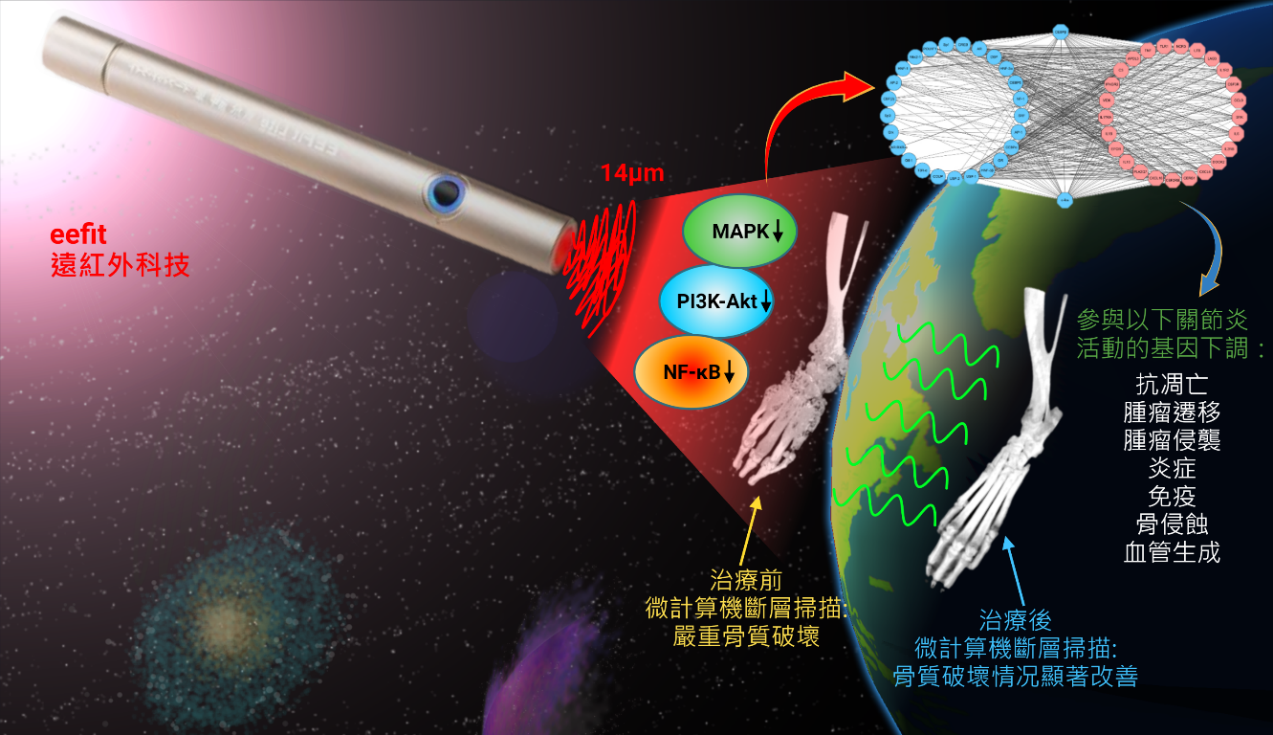
▲文章内图
【分子和细胞机制】
研究团队一直在深入探索这种疾病在分子和细胞层面的运作方式。其中一项研究发现了一种被用于对抗炎症的中药单体化合物celastrol,它可以干扰关节细胞中的钙平衡,导致自噬性细胞死亡和减轻关节炎症状[3]。这一发现表明,干扰发炎细胞中的钙平衡可能是应对关节炎的一种新方法。无独有偶,研究人员还发现了一种名为Sirtuin 5(SIRT5)的长寿蛋白,它有助于调控体内的能量代谢和炎症反应[4],增加SIRT5的表达水平能够显著减轻类风湿性关节炎症状。此外还有一项令人兴奋的研究专注于特定基因突变,如p53肿瘤抑制基因突变体(p53R211*),它可以使免疫系统T-细胞冷静下来并降低炎症,为类风湿性关节炎开辟了新的治疗方向[5]。
在探索治疗方法方面,研究人员还在研究非编码RNA的作用,这可能有助于早期诊断类风湿性关节炎并协助评估治疗效果,为更个性化的护理和治疗铺平道路[6]。同时,研究人员发现清除积累的DNA碎片可能是预防风湿性关节炎进展的新方法[7]。这些突破性的发现都为了解和治疗类风湿性关节炎开辟了新的途径。
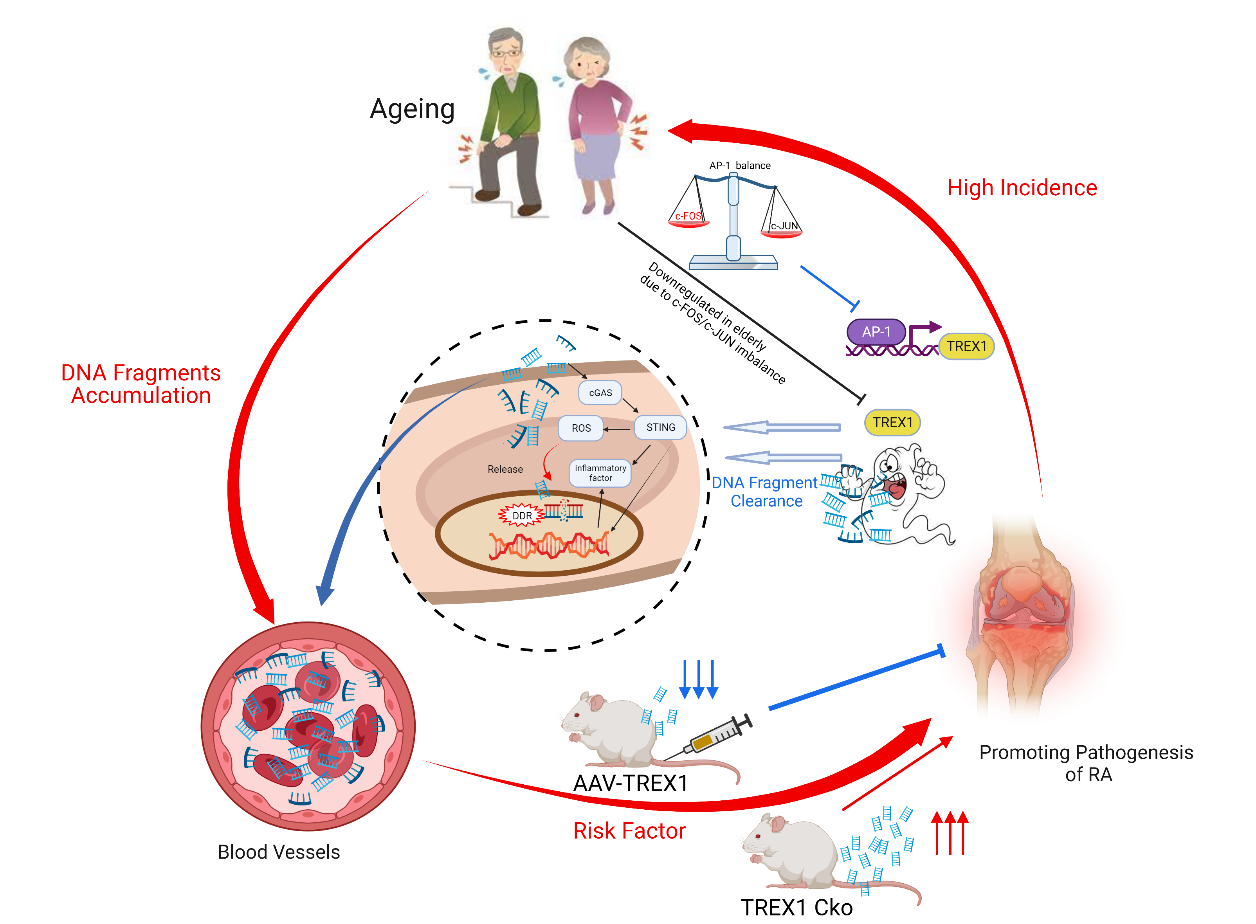
▲文章内图
【治疗方法和治疗机制】
在探索创新的治疗方法中,研究人员发现一个有前景的非药物治疗方法——远红外线辐射(FIR),它通过抑制该疾病的特定基因活性成功减缓了炎症[8]。此外,研究人员将epalrestat与抗氧化剂“N-乙醯半胱氨酸(NAC)”结合使用,这样可以克服目前治疗RA的一些缺点,如减轻毒性和炎症反应,因为单独使用epalrestat可能会通过积聚有害物质而加重症状[9]。
研究人员在对抗药物耐药性的研究上也取得了进展,他们发现 p53肿瘤抑制基因的突变可能使某些关节炎药物的疗效降低,这表明需要个体化的治疗策略来改善患者的治疗效果[10]。
无论是从揭开错综复杂的分子和细胞机制,或是探索创新的治疗策略,团队的研究人员都在持之以恒地努力着。这些研究成果不仅为类风湿性关节炎的治疗开辟了新的道路,也为这种慢性疾病找到更有效的管理方法,让受影响的 RA患者看到了希望。怀揣着这份初心,研究团队将继续坚定地在治愈类风湿性关节炎的道路上前进。

▲黄锦伟教授团队
Reference:
[1] World Health Organization, “Rheumatoid arthritis,” https://www.who.int/news-room/fact-sheets/detail/rheumatoid-arthritis
[2] Q. Ding et al., “Signaling pathways in rheumatoid arthritis: implications for targeted therapy,” Sig Transduct Target Ther, vol. 8, no. 1, p. 68, Feb. 2023, doi: 10.1038/s41392-023-01331-9.
[3] V. K. W. Wong et al., “Ca2+ signalling plays a role in celastrol‐mediated suppression of synovial fibroblasts of rheumatoid arthritis patients and experimental arthritis in rats,” British J Pharmacology, vol. 176, no. 16, pp. 2922–2944, Aug. 2019, doi: 10.1111/bph.14718.
[4] N. Zhang et al., “Sirtuin 5 deficiency increases disease severity in rats with adjuvant-induced arthritis,” Cell Mol Immunol, vol. 17, no. 11, pp. 1190–1192, Nov. 2020, doi: 10.1038/s41423-020-0380-4.
[5] Y. Zeng et al., “Mutant p53R211* ameliorates inflammatory arthritis in AIA rats via inhibition of TBK1-IRF3 innate immune response,” Inflamm. Res., vol. 72, no. 12, pp. 2199–2219, Dec. 2023, doi: 10.1007/s00011-023-01809-w.
[6] J. Yang et al., “The role of non-coding RNAs (miRNA and lncRNA) in the clinical management of rheumatoid arthritis,” Pharmacological Research, vol. 186, p. 106549, Dec. 2022, doi: 10.1016/j.phrs.2022.106549.
[7] W.-D. Luo et al., “Age-related self-DNA accumulation may accelerate arthritis in rats and in human rheumatoid arthritis,” Nat Commun, vol. 14, no. 1, p. 4394, Jul. 2023, doi: 10.1038/s41467-023-40113-3.
[8] X. Chen et al., “Far infrared irradiation suppresses experimental arthritis in rats by down-regulation of genes involved inflammatory response and autoimmunity,” Journal of Advanced Research, vol. 38, pp. 107–118, May 2022, doi: 10.1016/j.jare.2021.08.015.
[9] L. Wang et al., “N -Acetylcysteine overcomes epalrestat-mediated increase of toxic 4-hydroxy-2-nonenal and potentiates the anti-arthritic effect of epalrestat in AIA model,” Int. J. Biol. Sci., vol. 19, no. 13, pp. 4082–4102, 2023, doi: 10.7150/ijbs.85028.
[10] C. Qiu et al., “The potential development of drug resistance in rheumatoid arthritis patients identified with p53 mutations,” Genes & Diseases, vol. 10, no. 6, pp. 2252–2255, Nov. 2023, doi: 10.1016/j.gendis.2023.02.007.



























