澳科大侯盼盼科研團隊在Cell Research發表文章
在心臟離子通道研究領域中取得新突破
澳門科技大學中藥機制與質量全國重點實驗室、埃爾文內爾生物物理與創新藥物實驗室侯盼盼助理教授科研團隊近日在心臟離子通道研究領域取得新突破。
合作團隊通過整合冷凍電鏡與電生理技術,解析了心臟中關鍵的KCNQ1+KCNE1通道高分辨率結構,並提出由「二級結構轉換,Secondary structure transitions」決定的獨特門控機制。研究成果學術論文以澳科大為第一署名單位,於10月2日發表於國際權威期刊Cell Research(IF=25.9),題為:Secondary structure transitions and dual PIP2 binding define cardiac KCNQ1-KCNE1 channel gating。

心臟IKs鉀通道由功能亞基KCNQ1和輔助亞基KCNE1組成,其介導的慢激活延遲整流鉀電流是控制心臟動作電位複極化的關鍵電流之一,在運動、情緒激動等應激狀態下的「戰逃反應」中發揮重要作用。KCNQ1或KCNE1基因突變可引起長QT綜合征(LQT1/LQT5),是青少年心源性猝死的主要遺傳病因,占臨床病例三分之一以上。
KCNE1的結合會重塑KCNQ1通道的特性,包括通道動力學(激活和去激活減慢、宏觀電流和單通道電導增加、G-V曲線右移等)、離子通透性和藥理特性。這些關鍵的生物物理特性改變,直接決定了IKs電流在心臟電生理中的特殊作用:其慢激活特性使其主要參與動作電位Phase 3複極化過程,從而對心率的調節具有獨特意義。
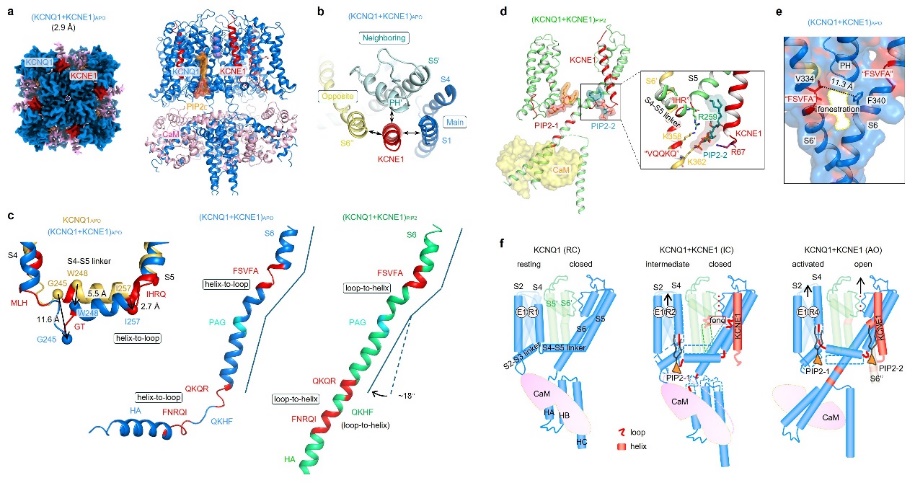
圖1 二級結構轉換與雙PIP2結合定義心臟KCNQ1-KCNE1鉀通道的門控
本研究系統闡明了KCNE1調控KCNQ1通道的結構基礎及藥理特性,取得了以下新發現:1)KCNE1結合在三個KCNQ1亞基交界處的關鍵位置,能夠同時與通道的多個功能域相互作用,為其廣泛調節通道的功能提供了結構依據(圖1a,b)。2)KCNE1的結合引發通道發生大規模的二級結構轉換(α螺旋與無序環狀結構之間的轉換),使原本相對剛性的α螺旋轉變為更為柔軟的無序結構。該轉換在通道開關過程中頻繁發生,導致IKs電流激活緩慢,從而特異性參與心臟Phase 3複極化過程(圖1c)。3)本研究還發現IKs通道的開關受到兩個PIP2分子的共同調控,其中一個在通道開關過程中穩定結合,另一個僅在開放態時與通道結合(圖1d)。這一機制顯著區別於僅受單個PIP2分子調控的KCNQ1及KCNQ1+KCNE3通道。4)本研究進一步發現IKs通道特有的「側窗」藥物結合口袋(圖1e),為開發高特異性靶向該通道的新型藥物提供了新思路。
這項研究結合結構解析與功能驗證,首次發現了離子通道通過大規模的「二級結構轉換」介導的門控新範式(圖1f)。類似機制可能在HCN、BK、Nav、TRP等不同類型的通道中都普遍存在,參與調控多種門控特性和生理藥理功能。
這項研究不僅深化了離子通道基礎門控機制的理解,也為病理機制的闡明和創新治療方案的開發奠定了堅實的基礎。這項研究獲得了澳門科技發展基金、國家自然科學基金、國家科技部與澳門科技發展基金聯合項目、澳門科技大學研究基金的資助。

侯盼盼科研團隊合影




























